

Cálculos Estequiométricos
Nas
reações químicas, é importante se prever a quantidade de produtos que podem
ser obtidos a partir de uma certa quantidade de reagentes consumidos. Os cálculos
que possibilitam prever essa quantidade são chamados de cálculos estequiométricos
(A palavra estequiometria vem do grego stoicheia (partes mais simples) e metreim
(medida)).
Essas quantidades podem ser expressas de diversas maneiras: massa, volume, quantidade de matéria (mol), número de moléculas.
Os cálculos estequiométricos baseiam-se nos coeficientes da equação. É importante saber que, numa equação balanceada, os coeficientes nos dão a proporção em mols dos participantes da reação.
Nos meados do século XVIII, cientistas conseguiram expressar matematicamente certas regularidades que ocorrem nas reações químicas, baseando-se em leis de combinações químicas que foram divididas em ponderais (que se relacionam às massas dos participantes da reação) e volumétricas (explicam a relação entre os volumes das substâncias gasosas que participam de um processo químico).
Lei
da conservação da massa ou Lei de Lavoisier: “Em
um sistema, a massa total dos reagentes é igual à massa total dos produtos”.
Veja o exemplo:
A
+ B à AB
2g
5g 7g
Lei
das proporções definidas ou Lei de Proust:
“ Toda substância apresenta uma proporção constante em massa, na sua
composição, e a proporção na qual as substâncias reagem e se formam é
constante”. Veja o exemplo:
A
+ B à AB
2g
5g 7g
4g
10g 14g
Com
a Lei de Proust podemos prever as quantidades das substâncias que participarão
de uma reação química.
Exercícios
1.
(Cesgranrio-RJ) De acordo com a Lei de Lavoisier, quando fizermos reagir
completamente em ambiente fechado, 1,12g de ferro com 0,64g de enxofre, qual será
a massa, em g, de sulfeto de ferro obtida? R:1,76
2. Complete o quadro:
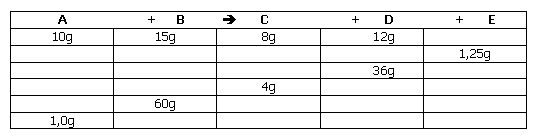
Lei
volumétrica:
Lei
de Gay-Lussac: “Os volumes
de todas as substâncias gasosas envolvidas em um processo químico estão entre
si em uma relação de números inteiros e simples, desde que medidos à mesma
temperatura e pressão”. Veja o exemplo:
1
L de H2 +
1 L de Cl2 à
2 L de HCl relação
de números inteiros e simples: 1:1:2
Cabe
aqui observar que nem sempre a soma dos volumes dos reagentes é igual à dos
produtos. Isso quer dizer que não existe lei de conservação de volume, como
ocorre com a massa. Veja o exemplo:
10
L de H2 +
5 L de O2 à
10 L de H2O relação
de números inteiros e simples: 10:5:10, que pode ser simplificada por 2:1:2
Lei
ou hipótese de Avogadro:
“Volumes iguais de gases diferentes possuem o mesmo número de moléculas,
desde que mantidos nas mesmas condições de temperatura e pressão”. Para
melhor entender a Lei de Gay-Lussac, o italiano Amedeo Avogadro introduziu o
conceito de moléculas, explicando por que a relação dos volumes é dada por números
inteiros. Dessa forma foi estabelecido o enunciado do volume molar.
Os dados do problema podem vir expressos das mais diversas maneiras: quantidade de matéria (mol), massa, número de moléculas, volume, etc.
Em todos esses tipos de cálculo estequiométrico vamos nos basear nos coeficientes da equação que, como vimos, dão a proporção em mols dos componentes da reação.
1ª
regra: Escreva
corretamente a equação química mencionada no problema (caso ela não tenha
sido fornecida);
2ª
regra: As
reações devem ser balanceadas corretamente (tentativa ou oxi-redução),
lembrando que os coeficientes indicam as proporções em mols dos reagentes e
produtos;
3ª
regra: Caso
o problema envolva pureza de reagentes, fazer a correção dos valores,
trabalhando somente com a parte pura que efetivamente irá reagir;
4ª
regra: Caso
o problema envolva reagentes em excesso – e isso percebemos quando são
citados dados relativos a mais de um reagente – devemos verificar qual deles
está correto. O outro, que está em excesso, deve ser descartado para efeito de
cálculos.
5ª
regra: Relacione,
por meio de uma regra de três, os dados e a pergunta do problema, escrevendo
corretamente as informações em massa, volume, mols, moléculas, átomos, etc.
Lembre-se de não podemos esquecer a relação:
1 mol = ......g = 22,4 L (CNTP) = 6,02x1023
6ª regra: Se o problema citar o rendimento da reação, devemos proceder à correção dos valores obtidos.
Veja
alguns exercícios resolvidos e a aplicação das regras:
Relação massa-massa: os dados do problema e as quantidades solicitadas são expressos em termos de massa
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual a massa, em g, de NH3 obtida, quando se
reagem totalmente 18g de H2?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (18g de H2) e o que está sendo solicitado
(massa de NH3) e estabeleça uma regra de três.
3H2 --------------
2NH3
3x2g -------------- 2x17g
18g --------------
y à
y= 102g
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual a massa, em kg, de NH3 obtida, quando se
reagem totalmente 280g de N2?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (280g de N2) e o que está sendo solicitado
(massa de NH3 em kg) e estabeleça uma regra de três.
1N2 --------------
2NH3
1x28g ----------- 2x17g
280g --------------
y à
y= 340g à
y= 0,34 kg
Relação massa-volume: os dados do problema são expressos em termos de massa e a quantidade solicitada é expressa em volume.
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual o volume de NH3 obtido nas CNTP, quando se
reagem totalmente 18g de H2?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (18g de H2) e o que está sendo solicitado
(volume de NH3 nas CNTP) e estabeleça uma regra de três.
3H2 --------------
2NH3
3x2g -------------- 2x22,4L
18g --------------
y à
y= 134,4L
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual o volume de H2 consumido nas CNTP, quando é
produzido 340g de NH3?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (340g de NH3) e o que está sendo solicitado
(volume de H2 em L nas CNTP) e estabeleça uma regra de três.
3H2 --------------
2NH3
3x22,4L --------- 2x17g
y --------------
340g
à
y= 672L
Relação massa-número de moléculas: os dados do problema são expressos em termos de massa e a quantidade solicitada é expressa em número de moléculas.
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual o número de moléculas de NH3 obtido, quando se
reagem totalmente 18g de H2?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (18g de H2) e o que está sendo solicitado
(número de moléculas de NH3) e estabeleça uma regra de três.
3H2 --------------
2NH3
3x2g -------------- 2x6,02x1023
18g --------------
y à
y= 36,12x1023 à
y= 3,612x1024 moléculas
RESOLVIDO
- Na reação gasosa N2 + H2 à
NH3, qual o número de moléculas de H2 consumido, quando
é produzido 340g de NH3?
Acerte
os coeficientes da equação: 1N2
+3H2 à
2NH3.
Veja os dados informados (340g de NH3) e o que está sendo solicitado
(número de moléculas de H2) e estabeleça uma regra de três.
3H2 --------------
2NH3
3x6,02x1023
--------- 2x17g
y
--------------
340g
à
y= 180,6x1023 à
y= 1,806x1025
Pureza: É comum o uso de reagentes impuros, principalmente em reações industriais, ou porque são mais baratos ou porque já são encontrados na natureza acompanhados de impurezas (o que ocorre, por exemplo, com os minérios).
Grau de pureza: é o quociente entre a massa da substância principal e a massa total da amostra (ou massa do material bruto).
RESOLVIDO - Em 200g de calcário encontramos 180g de CaCO3 e 20g de impurezas. Qual o grau de pureza do calcário?
200g
-------------100%
180g ------------- y à
y = 90%
RESOLVIDO
- Uma amostra de 200 kg de calcário (com teor de 80% de CaCO3) foi
tratada com ácido fosfórico - H3PO4 - conforme a
equação química balanceada:
3CaCO3 + 2H3PO4 à
1Ca3(PO4)2 + 3H2O + 3CO2.
Calcule a massa de Ca3(PO4)2 formado.
Os
coeficientes já estão acertados:
3CaCO3 + 2H3PO4
à
1Ca3(PO4)2 + 3H2O
+ 3CO2
Veja os dados informados (200 kg de Calcário com 80% de pureza, ou seja, temos
apenas 160kg de CaCO3) e o que está sendo solicitado (massa do sal
formado - Ca3(PO4)2)
e estabeleça uma regra de três.
3CaCO3 --------------
1Ca3(PO4)2
3x100g----------------
1x310g
160kg
---------------
y
à
y=165,33 kg
RESOLVIDO - Considere a reação FeS + HCl à FeCl2 + H2S. Qual a massa de cloreto ferroso - FeCl2 - obtida quando 1100g de sulfeto ferroso - FeS de 80% de pureza reagem com excesso de ácido clorídrico - HCl?
Acerte
os coeficientes da equação: 1FeS + 2HCl
à
1FeCl2
+ 1H2S
Veja os dados informados (1100g de sulfeto ferroso com 80% de pureza, ou seja,
880g de sulfeto ferroso puro) e o que está sendo solicitado (massa de cloreto
ferroso) e estabeleça uma regra de três.
1FeS --------------
1FeCl2
1x88g
------------- 1x127g
880g
--------------
y
à
y= 1270g
Rendimento de uma reação é o quociente entre a quantidade de produto realmente obtida e a quantidade de produto que seria teoricamente obtida pela equação química correspondente.
RESOLVIDO - Queimando-se 30g de carbono puro, com rendimento de 90%, qual a massa de dióxido de carbono (CO2) obtida, conforme a equação: C + O2 à CO2 .
Os
coeficientes já estão acertados:
1C + 1O2 à
1CO2 .
Veja os dados informados (30g de Carbono puro com 90% de rendimento) e o que
está sendo solicitado (massa de dióxido de carbono obtida)
e estabeleça uma regra de três.
1C --------------
1CO2
1x12g------------- 1x44g
30g ---------------
y
à
y=110g (considerando que o rendimento seria de 100%)
estabeleça outra regra de três para calcular o rendimento (90%)
110g
-------------100% (rendimento teórico)
z --------------- 90% z= 99g
Quando são dadas as quantidades de dois ou mais participantes: É importante lembrar que as substâncias não reagem na proporção que queremos (ou que as misturamos), mas na proporção que a equação (ou seja, a Lei de Proust) as obriga. Quando o problema dá as quantidades de dois participantes, provavelmente um deles está em excesso, pois, em caso contrário, bastaria dar a quantidade de um deles e a quantidade do outro seria calculada. Para fazer o cálculo estequiométrico, baseamo-nos no reagente que não está em excesso (denominado reagente limitante).
Nesse caso devemos seguir as etapas:
1ª - Considere um dos reagentes o limitante e determine quanto de produto seria formado;
2ª - Repita o procedimento com o outro reagente;
3ª - A menor quantidade de produto encontrada corresponde ao reagente limitante e indica a quantidade de produto formada.
RESOLVIDO
- Foram misturados 40g de gás hidrogênio (H2) com 40g de gás
oxigênio, com a finalidade de produzir água, conforme a equação: H2
+ O2 à
H2O.
Determine:
a)o reagente limitante;
b)a massa de água formada;
c)a massa de reagente em excesso.
Acerte
os coeficientes da equação:2H2
+1O2 à
2H2O.
Vamos considerar que o H2 seja o reagente limitante.
2H2
---------------
2H2O
2x2g-------------------2x18g
40g ------------------
y y=360g
Em
seguida, vamos considerar que o O2 seja o reagente limitante.
1O2
---------------
2H2O
1x32g-----------------2x18g
40g ------------------
y y=45g
Observe que a menor quantidade água corresponde ao consumo total de O2, que é realmente o reagente limitante. A massa de água produzida será de 45g.
Agora vamos calcular a massa de H2 que será consumida e o que restou em excesso, aplicando uma nova regra de três:
2H2
---------------
2O2
2x2g-------------------2x32g
z ------------------
40g z=5g
(massa de H2 que irá reagir)
Como
a massa total de H2 era de 40g e só 5g irá reagir, teremos um
excesso de 35g (40-5).
Dessa forma, passaremos a responder os quesitos solicitados:
a)reagente
limitante: O2
b)massa de água formada: 45g
c)massa de H2 em excesso: 35g
Exercícios propostos
Qual a massa de água que se forma na combustão de 1g de gás hidrogênio
(H2), conforme a reação H2 + O2 à
H2O?
R:9
Sabendo
que 10,8g de alumínio reagiram completamente com ácido sulfúrico,
conforme a reação: Al + H2SO4 à
Al2(SO4)3 + H2, calcule:
a)massa de ácido sulfúrico consumida;
b)massa de sulfato de alumínio produzida;
c)volume de gás hidrogênio liberado, medido nas CNTP.
R: a)58,8g b)68,4g c) 13,44L
Qual
a massa de gás oxigênio necessária para reagir com 560g de monóxido de
carbono, conforme a equação: CO + O2 à
CO2
?
R: 320g
Calcular a massa de óxido cúprico (CuO) a partir de 5,08g de cobre metálico,
conforme a reação: Cu + O2 à
CuO.
R:6,36
Efetuando-se
a reação
entre 18g de alumínio e 462g de gás cloro, segundo a equação química:
Al +
Cl2 à
AlCl3 , obtém-se qual quantidade máxima de cloreto de alumínio?
R: 89g
Quantos
mols de O2 são obtidos a partir de 2,0 mols de pentóxido de
dinitrogênio (N2O5), de acordo com a reação: N2O5
+ K2O2 à
KNO3
+ O2
R: 1,0
Quantas moléculas de gás carbônico podem ser obtidas pela queima de
96g de carbono puro, conforme a reação: C + O2 à
CO2?
R:4,816x1024
(Faap-SP) A combustão do metanol (CH3OH) pode ser
representada pela equação não balanceada: CH3OH + O2
à
CO2 + H2O. Quando se utilizam 5,0 mols de metanol nessa
reação, quantos mols de gás carbônico são produzidos?
R:5
Quantas
moléculas de gás oxigênio reagem com 6 mols de monóxido de carbono,
conforme a equação: CO + O2 à
CO2
R: 1,806x1024
(UECE)
Uma vela de parafina queima-se, no ar ambiente, para formar água e dióxido
de carbono. A parafina é composta por moléculas de vários tamanhos,
mas utilizaremos para ela a fórmula C25H52.
Tal reação representa-se pela equação: C25H52 + O2
à
H2O
+ CO2 . Responda:
a)Quantos mols de oxigênio são necessários para queimar um mol de
parafina?
b)Quanto pesa esse oxigênio?
R: a) 38 b) 1216g
O ácido sulfúrico de larga utilização e fator determinante do índice
de desenvolvimento de um país, é obtido pela reação SO3 + H2O
à
H2SO4.
Reagimos 80g de trióxido de enxofre (SO3) com água em excesso e
condições necessárias. Qual a massa de ácido sulfúrico obtida nessa reação
que tem rendimento igual a 75%?
R:73,5
Quais são as massas de ácido sulfúrico e hidróxido de sódio necessárias
para preparar 28,4g de sulfato de sódio, conforme a reação: H2SO4
+ NaOH à
Na2SO4 + H2O?
R:19,6 e 16
400g
de hidróxido de sódio (NaOH) são adicionados a 504g de ácido nítrico
(HNO3), produzindo nitrato de sódio (NaNO3) e água.
Calcule:
a)massa de nitrato de sódio obtida;
b)massa do reagente em excesso, se houver.
R: a) 680g b) 80g de NaOH
(UFRN) Uma amostra de calcita, contendo 80% de carbonato de cálcio (CaCO3),
sofre decomposição quando submetida a aquecimento, segundo a reação:
CaCO3 à
CaO + CO2.
Qual a massa de óxido de cálcio obtida a partir da queima de 800g de calcita?
R:358,4
Qual
a quantidade máxima de NH3 , em gramas, que pode ser obtida a
partir de uma mistura de 140g de gás nitrogênio (N2) com 18g de
gás hidrogênio (H2), conforme a reação: N2 + H2
à
NH3
R: 102g
(PUC-MG) A equação de ustulação da pirita (FeS) é: FeS + O2
à
SO2 + Fe2O3. Qual a massa de óxido de ferro
III obtida, em kg, a partir de 300 kg de pirita, que apresenta 20% de impurezas?
R:218,18
(Fuvest-SP)
Qual a quantidade máxima, em gramas, de carbonato de cálcio que pode ser
preparada misturando-se 2 mols de carbonato de sódio com 3 mols de cloreto
de cálcio, conforme a equação: Na2CO3 + CaCl2
à
CaCO3 + NaCl.
R: 200g
32,70g de zinco metálico (Zn) reagem com uma solução concentrada de
hidróxido de sódio (NaOH), produzindo 64,53g de zincato de sódio (Na2ZnO2).
Qual o rendimento dessa reação?
R:89,69%
Misturam-se 147g de ácido sulfúrico e 100g de hidróxido de sódio que se reajam segundo a reação: H2SO4 + NaOH à Na2SO4 + H2O. Qual a massa de sulfato de sódio formada? Qual a massa do reagente que sobra em excesso após a reação? R:177,5 e 24,5
Para a produção de soda cáustica (NaOH), uma indústria reage
carbonato de sódio com hidróxido de cálcio segundo a equação: Na2CO3
+ Ca(OH)2 à
CaCO3 + NaOH. Ao reagirmos 265g de carbonato de sódio com 80% de
pureza, devemos obter que massa, em gramas, de soda cáustica?
R:160
(UFF-RJ) O cloreto de alumínio é um reagente muito utilizado em
processos industriais que pode ser obtido por meio da reação entre alumínio
metálico e cloro gasoso, conforme a seguinte reação química:
Al + Cl2 à
AlCl3. Se 2,70g de alumínio são misturados a 4,0g de cloro, qual a
massa produzida em gramas, de cloreto de alumínio?
R:5,01
Quantas moléculas de gás carbônico (CO2) podem ser obtidas
pela queima completa de 9,6g de carbono puro, conforme a reação C + O2
à
CO2?
R:4,816x1023
Qual a massa, em gramas, de
cloreto de ferro II (FeCl2), em gramas, produzida pela reação
completa de 111,6g de Fe com ácido clorídrico (HCl), de acordo com a reação
química não-balanceada a seguir Fe + HCl à
FeCl2 + H2 ?
R: 253,09
Dada a reação não-balanceada Fe+ HCl à
FeCl3 + H2, qual o número de moléculas de gás hidrogênio
produzidas pela reação de 112g de ferro?
R:1,806x1024
Qual
a quantidade de água formada a partir de 10g de gás hidrogênio,
sabendo-se que o rendimento da reação é de 80%?
R: 72g
Quantos mols de ácido clorídrico (HCl) são necessários para produzir
23,4g de cloreto de sódio (NaCl), conforme a reação HCl + NaOH à
NaCl + H2O?
R:0,4
(Cesgranrio-RJ) Um funileiro usa um maçarico de acetileno para soldar
uma panela. O gás acetileno (C2H2) é obtido na hora,
através da seguinte reação química:
CaC2 + H2O à
Ca(OH)2 + C2H2.
Qual a massa aproximada de carbureto de cálcio (CaC2) que será
necessária para se obter 50 L de acetileno nas CNTP?
R:142,8
Em alguns antiácidos, emprega-se o hidróxido de magnésio (Mg(OH)2)
como agente neutralizante do
ácido clorídrico (HCl)
contido no suco gástrico. A reação que ocorre é a seguinte: Mg(OH)2
+ HCl à
MgCl2 + H2O. Supondo-se que alguém tenha 36,5 mg de HCl
no estômago, qual a massa de hidróxido de magnésio, em mg, necessária para
uma neutralização completa?
R:29
A produção de carboidratos (fórmula mínima CH2O) pelas
plantas verdes obedece à equação geral da fotossíntese: CO2 + H2O
à
CH2O + O2. Qual a massa de água necessária para produzir
10g de carboidrato?
R:6
(Fuvest-SP) Qual a quantidade máxima de carbonato de cálcio (CaCO3)
que pode ser preparada a partir de 2 mols de carbonato de sódio com 3 mols de
cloreto de cálcio, conforme a reação: Na2CO3 + CaCl2
à
CaCO3 + NaCl?
R:200
(Cesgranrio-RJ) Ao mergulharmos uma placa de prata metálica em uma solução
de ácido nítrico (HNO3), ocorrerá a reação: Ag + HNO3
à
AgNO3 + NO + H2O. Ajustando a reação química, calcule a
massa de água produzida, em gramas, quando é consumido 1 mol de prata metálica.
R:12
4g
de hidróxido de sódio (NaOH) são adicionados a 4g de ácido clorídrico (HCl),
produzindo cloreto de sódio (NaCl) e água. Pergunta-se: há excesso de
qual reagente?
R: 0,35g de HCl
(Fatec-SP) Na reação de amônia (NH3) com oxigênio (O2)
para formar NO e água, qual a massa de água formada a partir de 160g de O2?
Quantos mols de NO são formados a partir da mesma quantidade de O2?
R:108g e 4 mols
Na produção de cal virgem (CaO), pela decomposição térmica do
carbonato de cálcio, ocorre a seguinte reação: CaCO3 à
CaO + CO2. Com base nessa informação, calcule a massa, em kg,
de cal virgem que será obtida a partir de 0,5 t de carbonato de cálcio.
R: 280
Ao reagirmos propeno com ácido clorídrico, obtemos 2-cloro-propano,
segundo a reação que segue. C3H6 + HCl à
C3H7Cl. Se reagirmos 84g de propeno (C3H6),
qual a massa de 2-cloro-propano obtida, se o rendimento da reação é de 60%?
R:94,2
Um dos processos de obtenção de éter hospitalar (C4H10O)
consiste na desidratação de álcool etílico
(C2H5OH), conforme a reação: C2H5OH
à
C4H10O + H2O. Pede-se para determinar o
rendimento desse processo, se quando desidratamos 184g de álcool, obtêm-se
111g de éter.
R:75%
O nitrato de potássio (KNO3) é conhecido pelas suas
propriedades diuréticas. Uma das reações em que podemos obter este composto
é dada a seguir:
AgNO3 + KCl à
KNO3 + AgCl.
Dispondo de 425g de nitrato de prata com 80% de pureza, qual a massa de nitrato
de potássio que obtemos se o rendimento da reação é de 60%?
R:121,2
O salitre do Chile (NaNO3) é utilizado como conservante em
embutidos como o presunto, mortadela, etc. Esse composto pode ser obtido pela
reação:
HNO3 + NaOH à
NaNO3 + H2O. Sendo a massa de ácido nítrico (HNO3)
utilizada igual a 126g, qual a massa de salitre do Chile que obtemos se o
rendimento dessa reação é de 95%?
R:161,5
(Cesgranrio-RJ) O H2S reage com o SO2 segundo a reação:
H2S + SO2 à
S + H2O. Qual o número máximo de mols de enxofre que pode ser
formado quando se faz reagir 5 mols de H2S com 2 mols de SO2?
R:6
12g
de ferro (Fe) e 4g de enxofre (S) são aquecidos até reação total. Tendo
em conta que o produto obtido é o sulfeto ferroso (FeS), qual dos dois
reagentes foi posto em excesso?
R:5g de ferro
(PUC-RJ) A nave estelar Enterprise, de Jornada nas estrelas,
usou B5H9 e O2 como mistura combustível. As
duas substâncias reagem de acordo com a seguinte equação:
B5H9 + O2
à
B2O3 + H2O. Se um tanque contém 126 kg de B5H9
e o outro 240 kg de O2, qual tanque esvaziará primeiro? Mostre com cálculos.
Quanta água terá sido formada (em kg) quando um dos reagentes tiver sido
completamente consumido?
R:101,25 kg
11,2
L de gás carbônico (CO2), nas CNTP, reagem com hidróxido de
sódio (NaOH), produzindo carbonato de sódio (Na2CO3)
e água. Qual a massa de carbonato de sódio obtida, sabendo-se que o
rendimento da reação é de 90%?
R: 47,7g
(ITA-SP)
Calcule o máximo de massa de água que se pode obter partindo de 8,0 g de
hidrogênio e 32,0g de oxigênio. Indique qual o reagente em excesso e
quanto sobra do mesmo.
R: 36g de água; excesso de 4g de H2
(PUC-MG) Fosgênio, COCl2, é um gás venenoso. Quando
inalado, reage com a água nos pulmões para produzir ácido clorídrico , que
causa graves danos pulmonares, levando, finalmente, à morte; por causa disso, já
foi até usado como gás de guerra. A equação dessa reação é:
COCl2 + H2O à
CO2 + HCl.
Se uma pessoa inalar 198 mg de fosgênio, qual a massa, em mg, de ácido clorídrico
que se forma nos pulmões? R:146
5
kg de CaCO3 são totalmente decompostos, conforme a reação
química:
CaCO2 à
CaO + CO2 . Calcule:
a)massa em kg de CaO obtido;
b)o volume de gás carbônico obtido a 25ºC e 1 atm, considerando que o
volume molar é de 25 L/mol.
R: a)2,8kg b)1250L
Considere
a obtenção do ferro, utilizando óxido férrico, conforme a reação: Fe2O3
+ CO à
Fe
+ CO2 . Se utilizarmos 4,8 kg de óxido férrico, quanto teremos
de ferro, admitindo que a reação tenha um rendimento de 80%?
R: 2688g
Qual
o volume, em m3, de gás oxigênio, nas CNTP, necessário
para queimar totalmente 1200 kg de carvão, com 90% de pureza, conforme a
equação:
C + O2 à
CO2
R: 2016m3
(Unicamp-SP)
Na metalurgia do zinco, uma das etapas é a reação do óxido de zinco
(ZnO) com o monóxido de carbono (CO), produzindo zinco elementar (Zn) e
gás carbônico. Para cada 1000g de óxido de zinco que reage, qual a massa
de metal obtida?
R: 802,5g
Encontrou-se
uma amostra de mármore (CaCO3), cuja pureza era de 60%.
Decompondo-se 50g dessa amostra, obteve-se cal virgem (CaO) e gás
carbônico (CO2). Admitindo-se um rendimento de 70% para essa
reação, quantos mols de gás carbônico foram conseguidos?
R: 0,21 mol
Na
combustão do cicloexano (C6H12), qual a quantidade em
mols de oxigênio (O2) consumida, para um mol de cicloexano
queimado, conforme a equação:
C6H12 + O2 à
CO2 + H2O?
R: 9 mols
Qualquer dúvida envie um e-mail para Prof. João Neto